Quand mon ami, le professeur Potier, m'a demandé de prendre part à cette réunion commémorative, je me suis senti très réservé. Comme beaucoup d'anciens taupins je connaissais Berthollet de longue date. Vers 1950 j'avais essayé de lire " La statique chimique ". Cet exercice est tellement pénible que je m'étais alors juré de ne plus jamais recommencer de ma vie !
Puis j'ai réfléchi ; d'abord il est bien difficile de ne pas dire oui à un ami de plus de trente ans (dans ce cas particulier, sans allusion politique) ; ensuite j'ai pensé qu'un monsieur né au milieu du XVIIIème siècle, une époque dorée pour la science, au bord du lac d'Annecy à Talloire, non loin de l'auberge du père Bise, (il ne connaissait pas encore le père Bise, - mais peu importe) -, il m'a semblé qu'un tel homme ne peut pas être totalement mauvais. Je devais donc procéder à une nouvelle lecture de Berthollet.
On dispose d'une documentation assez abondante sur ses travaux : d'abord l'ouvrage " La statique chimique ", publié en 1803. Mais il y a aussi un texte beaucoup moins connu, un manuscrit préparé en 1814 en vue d'une édition nouvelle, revu en tenant compte de l'évolution des connaissances générales et des conceptions de l'auteur. Ce manuscrit a été découvert par le Professeur Jacques, et imprimé en 1980, grâce aux travaux de Madame Michèle Goupil. Les réflexions dont je vais maintenant vous faire part proviennent de la lecture de ce texte.
Voici d'abord le portrait de Berthollet, revu au moyen des artifices de l'informatique :

Il me paraissait beaucoup trop raide sur le tableau original accroché dans le couloir qui conduisait au bureau du Général, rue Descartes. J'ai connu ce tableau autrefois, justement dans ce couloir : j'avais été convoqué à plusieurs reprises pour avoir fabriqué un canon sans recul, peut-être le premier de l'armée française, qui servait avant tout à faire du chahut en tirant dans les couloirs. Le Général n'appréciait pas le résultat, pourtant remarquable. D'où ces convocations ! Je venais, je ne dirai pas en tremblant mais toutefois légèrement ému, dans ce même couloir où l'on entendait encore l'écho lointain des hurlements que poussait le Général Aupick, quand il se disputait avec son beau-fils, ce n'était que Baudelaire - dont la " moralité " lui causait bien des soucis.
Voici le deuxième volume de " La statique chimique " dans l'édition faite en 1980 par Madame Goupil. La lecture en est difficile, il faut vraiment réfléchir pour comprendre ce texte. On ne doit pas en vouloir à Berthollet, il utilisait des concepts qui étaient les siens, qui ont été abandonnés depuis et dont la signification nous échappe au premier abord ; il ne pouvait imaginer l'existence des principes de la thermodynamique, de l'entropie en particulier... Alors il mélangeait un peu tout. J'ai choisi quelques phrases pour illustrer cette difficulté :" Lorsque plusieurs acides agissent sur une base alcaline, l'action de l'un des acides ne l'emporte pas sur celle des autres de manière à former une combinaison isolée, mais chacun des acides a dans l'action une part (...) déterminée par sa capacité de saturation et par sa quantité (...) "
" On ne peut donc pas dire (...) qu'un acide en chasse un autre de la base avec laquelle il était combiné ; mais il partage l'action qui était exercée sur la base pour produire la saturation en raison des masses employées. "
Le point de départ de Berthollet est une idée fausse : l'idée que l'attraction universelle de Newton pouvait s'étendre à ce que l'on n'appelait pas encore des molécules : " Toutes les combinaisons et compositions sont sollicitées par deux forces : par une attraction à distance dans laquelle la quantité fait varier les effets, et une attraction de la surface dans laquelle les dimensions et les rapports de figure des lames qui la forment exercent leur influence. "
" ...les puissances qui produisent les phénomènes chimiques sont toutes dérivées de l'attraction mutuelle des corps à laquelle on a donné le nom d'affinité, pour la distinguer de l'attraction astronomique. "
Il répondait à un souci de généralité peut-être un peu trop prompt en supposant l'existence d'une attraction analogue à celle qui avait été si exactement décrite par Newton. Bien sûr, nous savons aujourd'hui que ce modèle ne représente pas correctement la réalité, mais Berthollet ne pouvait avoir une idée de l'échelle microscopique des phénomènes sur lesquels il travaillait. Cette notion d'affinité qu'il distingue de l'attraction astronomique, mais sans la définir autrement, n'est pas claire du tout. Elle n'était claire pour personne et pourtant elle a été utilisée par beaucoup de gens.
Ce n'est d'ailleurs pas lui qui l'a inventée. Elle paraît être née au début du XVIIIème siècle ; en 1775 le chimiste suédois Bergmann a publié un livre rédigé en latin dont le titre commence ainsi : " Disquisitio de attractionibus electivis ". Ce texte a été traduit en allemand (Berthollet, je crois, l'a lu en latin). Goethe a découvert cette traduction qui lui donna l'idée surprenante mais géniale, de considérer les rapports humains sous l'angle de la chimie. Voilà le seul exemple, à ma connaissance, où une idée venant de la chimie, fausse au demeurant, a donné naissance à un roman de génie, " Les affinités électives ", parfaitement clair, qu'on peut lire encore de nos jours avec un très grand plaisir.
Berthollet, né en dehors de France, en Savoie, s'exprimait cependant en français, mais il écrivait dans un style compliqué. Apparemment il ne s'était pas familiarisé avec le style de Voltaire qui pourtant, dans les dernières années de sa vie, ne résidait pas très loin de Talloire. Toutefois, parmi ces phrases difficiles, on trouve des idées intéressantes : " Puisqu'il est très vraisemblable que l'affinité ne diffère pas, dans son origine, de l'attraction générale, elle doit également être soumise aux lois ... ( de la mécanique )... et il est naturel de penser que plus les principes auxquels parviendra la théorie chimique auront de généralité plus ils auront d'analogie avec ceux de la mécanique ; mais ce n'est que par la voie de l'observation qu'ils doivent atteindre à ce degré, que déjà l'on peut indiquer. "
Cette idée que la théorie chimique, pour parvenir à la généralité, devra ressembler beaucoup à la mécanique, s'est développée longtemps, pendant tout le XIXème siècle et même au début du XXème. Elle a été abandonnée avec l'avènement de la mécanique quantique, mais elle a retrouvé quelque vigueur avec les nouvelles méthodes de calcul, comme celle qui a valu au Professeur Pople de recevoir le prix Nobel en 1998. On ne peut évidemment pas en déduire que Berthollet était un promoteur de ces méthodes !
Le rôle nécessaire de l'observation est une autre idée fondamentale à laquelle il était très attaché : elle devait empêcher les chimistes de se laisser aller à des discussions complètement éthérées, discussions qui avaient été souvent le prétexte à d'innombrables disputes.
" C'est donc l'observation seule qui doit servir à constater les propriétés des corps, ou les affinités par lesquelles ils exercent une action réciproque dans une circonstance déterminée. "
Cette affinité doit donc être définie par l'observation et non par une voie théorique, et cependant il voulait théoriser la chimie, il aurait même voulu la " mathématiser " . Ainsi, à propos encore de l'attraction gravitationnelle et de l'affinité il écrit : " Il est probable que l'une et l'autre ne sont qu'une même propriété ; mais l'attraction astronomique ne s'exerçant qu'entre des masses placées à une distance où la figure des molécules, leurs intervalles (...) n'ont aucune influence, ses effets peuvent être rigoureusement soumis au calcul ; les effets de l'attraction chimique (...) sont tellement altérés par les conditions particulières et souvent indéterminées, qu'on ne peut les déduire d'un principe général, mais il faut les constater successivement. " Il ne pouvait pas réussir à " mathématiser " la chimie, l'état général des connaissances en physique et en chimie était alors très éloigné d'un objectif aussi ambitieux.
Voici encore une autre idée qu'on trouve à plusieurs reprises dans l'ouvrage : les attractions qui s'exercent entre les molécules sont balancées par l'action de ce qu'il appelle le calorique, et par d'autres actions qui sont extrêmement mal définies : " Mais les résultats de ces deux forces sont modifiés par le calorique qui change les distances et qui fait disparaître l'effet de l'action particulière de la surface et même celui de l'action à distance ; par le fluide électrique dont l'action sur les combinaisons occupe aujourd'hui avec tant de succès les physiciens et les chimistes ; par la disposition à la solidité ou à l'état gazeux qui fait varier les effets du calorique et de l'électricité ; par l'action secondaire des dissolvants ; par la pesanteur spécifique ; par la compression et peut-être par d'autres forces encore inconnues. "
Tous ces concepts mal définis nécessitent une transcription, mais je tenais à vous présenter des extraits du texte exact sous sa forme brute afin que vous puissiez vous rendre compte des difficultés qu'il faut surmonter pour comprendre son raisonnement dans les détails. Donnons lui encore la parole : " Comme cette saturation réciproque des acides par les alcalis est l'effet immédiat de leur affinité réciproque, elle doit être regardée comme la mesure de leur affinité si l'on prend en considération les quantités respectives qui sont nécessaires pour produire le même effet. "
" L'affinité des différents acides pour une même base alcaline, est en raison inverse de la quantité pondérale de chacun d'eux qui est nécessaire pour la neutralisation avec une quantité égale de la même base alcaline (...) "
Nous constatons qu'il est toujours question d'affinité alors que, à aucun moment, il ne définit cette propriété. Il traite ensuite d'affinités qui devraient être constantes, il associait cela à l'idée qu'une substance, comme par exemple l'oxygène, devait avoir une affinité constante avec une autre substance déterminée, comme l'hydrogène. Puis, après de longues réflexions, ayant fait la liste des cas où l'expérience infirmait ce principe, il abandonna cette loi de la constance des affinités. Ce qui le conduisit à énoncer cet axiome, " (...) que l'on ne doit plus en chimie, soit pour diriger ses recherches, soit pour expliquer les phénomènes, se fonder sur les affinités considérées comme constantes. "
S'il avait vécu cent ans plus tard, il aurait compris facilement les causes de ses difficultés. Mais quand un scientifique émet des idées neuves trop tôt, elles ne sont pas comprises, pourtant on les imprime et elles demeurent incomprises parfois très longtemps !
Il a aussi longuement étudié la formation des précipités. De ses travaux dans ce domaine dérivent les "lois de Berthollet ", lesquelles prévoient que, quand on mélange deux solutions de sels, en général, il se forme un précipité. On enseigne ces lois, encore aujourd'hui, dans le cycle secondaire.
Il a étudié ces phénomènes de façon approfondie, cependant il ne croyait pas à la loi de Proust sur les proportions définies, il ne croyait pas à l'existence des atomes ! Il pensait que les proportions des corps dans une substance pouvaient varier d'une manière continue. Il considérait sur le même plan les mélanges, les solutions, et les combinaisons chimiques. Cela conduisait à des incohérences insurmontables. D'autant que, avec objectivité, il reconnaissait que dans certaines conditions particulières, des corps ne réagissaient effectivement que suivant des proportions bien déterminées ...
Brusquement, en 1810, il a cessé de publier. La raison de cette attitude est sans aucun doute le désespoir où l'a conduit le suicide de son fils Amédée. Voici d'ailleurs la copie, prêtée par le Professeur Jacques, d'un message manuscrit très émouvant par lequel Berthollet prie une de ses amies d'apprendre à la mère d'Amédée qu'elle n'a plus de fils.
Profondément touché par ce tragique événement il est resté plusieurs années sans travailler, du moins sans publier.
Pour terminer, il nous faut au moins expliquer pourquoi ce qu'il exposait dans un texte de plusieurs centaines de pages peut se condenser aujourd'hui dans un court chapitre d'un traité de thermodynamique.
La ligne suivante nous rappelle comment on écrit une réaction :
Les coefficients n appelés stchiométriques, sont des nombres entiers qui représentent à gauche les nombres respectifs des molécules des corps qui réagissent et, à droite, les nombres des molécules des corps obtenus. On convient de les prendre positifs à droite de la flèche, négatifs à gauche. Si on prend en considération les variables température et pression, pour définir révolution de la composition du système on a deux solutions
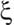 . Mais les nA1 - nk ne sont pas indépendants, ce qui complique les calculs.
. Mais les nA1 - nk ne sont pas indépendants, ce qui complique les calculs.
2. - Il est donc préférable, comme l'ont proposé De Donder et Prigogine, (qui a diffusé cette méthode dans un livre publié en 1950, longtemps après les travaux de Berthollet), de choisir comme variables T, P, et 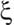 .
.
Alors les calculs se mettent en forme très facilement. Et nous allons voir réapparaître l'affinité, dite " de Berthollet ", mais qui ne représente plus le même concept.
Quand une réaction évolue, le système constitué des corps en présence se transforme de façon irréversible. Ceci est traduit symboliquement par la formule :
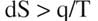
La lettre q désigne une forme différentielle linéaire qui dépend des différentielles des variables qui représentent l'évolution du système. L'expression dS représente la différentielle de l'entropie. Pendant longtemps les chimistes se sont contentés de cette formule.
Puis un jour Prigogine a proposé d'expliciter la différence entre dS et q/T, soit :
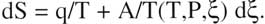
Et il ajoute la condition suivante : le produit A multiplié par 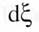 , doit être positif (pour satisfaire au second Principe).
, doit être positif (pour satisfaire au second Principe).
Ceci veut dire que si A est positif, 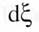 sera positif et la réaction évoluera de façon à former les constituants figurant à droite de la flèche, et inversement.
sera positif et la réaction évoluera de façon à former les constituants figurant à droite de la flèche, et inversement.
Cette quantité A, qu'il appelle à nouveau affinité, s'exprime à partir des potentiels chimiques, qui sont désignés par les symboles 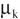 .
.
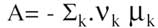
La définition et le rôle de ces potentiels chimiques nous ramènent en quelque sorte aux concepts auxquels Berthollet était parvenu en s'appuyant sur des bases expérimentales, mais il faut rappeler qu'ils dépendent de la pression et surtout de la température.
J'espère que ces indications sommaires vous auront permis de vous rendre compte de l'évolution très profonde du concept d'affinité. Mais avant de conclure je voudrais ajouter un commentaire à propos de deux manuscrits qui eux aussi ont été retrouvés par le Professeur Jacques.
Le premier, qui traite de photochimie, n'ajoute pas beaucoup au mérite de Berthollet, même si on en juge en tenant compte de l'état des connaissances au moment où il a été rédigé. Le second en revanche est très intéressant, il s'agit d'une sorte de commentaire des idées de Berzellius, qui était bien connu, en particulier pour avoir découvert que l'électrolyse permettait de décomposer certains composés. Ainsi on avait fabriqué du sodium par électrolyse de chlorure de sodium fondu. Berzellius en déduisait que si l'électricité pouvait provoquer la destruction de certains composés, il était bien possible qu'elle soit la " colle " réunissant les atomes qui les constituaient. Il me paraît important de noter que Berthollet dans son commentaire exprime son accord sur cette conception. Ce manuscrit écrit à la plume d'oie, sur un papier de médiocre qualité, sans pagination, est d'autant plus difficile à déchiffrer qu'il manque des chapitres. Cependant ce que j'ai pu en lire à ce jour éclaire de façon beaucoup plus positive les conceptions de Berthollet.
|
Après avoir remercié Monsieur Fétizon pour son exposé, le Professeur Potier invite les auditeurs qui le souhaiteraient à poser des questions.
Question : Il paraît surprenant, eu égard à l'importance des travaux de Berthollet pour l'évolution de la chimie, dans une période cruciale du progrès de la connaissance de la nature, qu'aucun musée n'honore sa mémoire. Pourquoi ? Réponse : M. Vallet, qui nous a quittés afin de participer à une autre cérémonie commémorative, se préoccupe d'en créer un. Il semble que des bonnes volontés vont soutenir cette initiative. M. Roth souhaite ajouter aux propos de M. Fétizon un bref commentaire en faveur de Berthollet : D'abord, pour ce qui concerne l'affinité, il est vrai qu'il ne l'a pas inventée. Celui qui l'a peut-être inventée, mais en se gardant bien de la nommer affinité, c'est Etienne François Geoffroy qui au début du 18ème siècle a publié une table des " rapports ", qui présentait pour la première fois de manière systématique l'action des différents acides se déplaçant les uns les autres. Mais il avait fait exprès de ne pas l'appeler affinité. Effectivement Bergmann a essayé d'étendre cette table, mais au fur et à mesure qu'il cherchait à l'étendre il rencontrait des difficultés, des cas particuliers, et alors que la table de Geoffroy tenait sur une simple page, celle de Bergmann est beaucoup plus volumineuse. Mais cette théorie a occupé beaucoup de gens, y compris Guyton de Morveau qui a écrit un article de 500 pages dans l'encyclopédie et qui a tenté de quantifier. Lavoisier qui était très prudent écrit dans son traité élémentaire de chimie qu'il ne traite pas de l'affinité parce que son " savant collègue, Guyton de Morveau, va y consacrer un article développé ". En fait, l'affinité s'est effondrée avec le développement de l'atomisme, parce qu'on ne distinguait pas, par exemple pour l'attraction de l'acide sulfurique avec le sodium et le calcium, le fait que dans un cas intervenaient deux atomes de sodium, et dans l'autre un seul atome de calcium. Et par conséquent cela conduisait aux confusions soulignées par M. Fétizon. Par ailleurs M. Roth voudrait défendre un peu Berthollet à propos de ses discussions avec Proust. Berthollet s'est beaucoup occupé de solides et quand on considère les oxydes d'uranium par exemple, il y a une assez grande continuité entre U O2, U3 08, et U 03, et ceci pouvait faire croire à un bon analyste que la règle des proportions définies n'était pas toujours rigoureuse. M. Fétizon souligne que son exposé sur l'affinité était un résumé. Ce concept a occupé de nombreux chimistes au cours du XVIIIème siècle, mais il a conduit à tellement d'erreurs et de disputes qu'il a été abandonné. Quand Prigogine a repris la notion d'affinité dans les années 1950 son initiative a paru surprenante. Peut-être a-t-il choisi ce terme tout simplement parce qu'il ignorait que d'autres l'avaient employé avant lui. Mais il n'y a pas de lien essentiel entre les deux concepts, le rapprochement signalé par M. Fétizon à propos des potentiels chimiques lui paraît plutôt superficiel. En commentaire à la remarque de M. Roth sur les oxydes d'uranium, M. Grison évoque l'introduction d'un ouvrage traitant de chimie des solides, dont il conserve un certain souvenir, dans laquelle l'auteur, anglo-saxon, affirme qu'il faut distinguer les " Daltonides " et les " Berthollides ". Les premiers, ce sont H2 O, SO4 H2 ; les seconds sont des phases solides qui ne sont pas stchiométriques, mais qui ne sont pas non plus intrinsèquement non stchiométriques, comme les cristaux qui le sont globalement mais qui, localement, ne le sont pas forcément. Cette appellation constitue bien une référence aux idées de Berthollet. M. Compin note que dans les articles traitant de l'histoire de la chimie on lit souvent que c'est l'observation de la cristallisation du carbonate de sodium dans les eaux du lac Natron qui a conduit Berthollet à réfléchir sur l'affinité et à poser la notion de masse chimique ; on lit aussi qu'il a tenté de reproduire cette réaction en laboratoire et qu'il a échoué, la cause de cet échec étant qu'il n'a pas réussi à modéliser l'action des roseaux. Ceci est-il bien confirmé ?
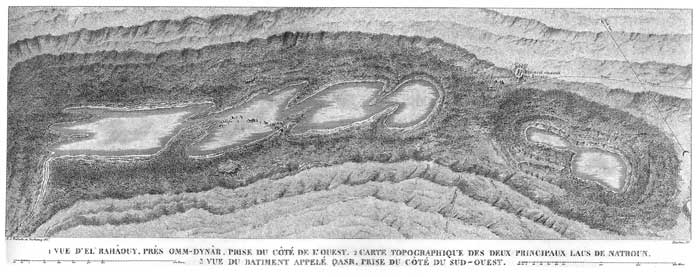 Le lac Natron tel que Berthollet l'inspecta en janvier 1799. Description de l'Egypte Archives de la Bibliothèque de l'Ecole polytechnique M. Bret confirme que Berthollet a visité en janvier 1799 le " Wadi an natron ", un lac situé à l'ouest du Caire, à une distance de 80 à 100 km. A l'époque on en extrayait du natron, et la France en importait. Ce lac est bien entouré de roseaux, comme d'autres lacs égyptiens situés plus au sud, dans la région de Keniah où l'on produisait aussi du natron. La reconstitution de cette réaction a été réalisée non pas par Berthollet lui-même, mais par un élève qu'il avait invité à faire ce travail, Joseph Regnault, un polytechnicien qui par la suite a abandonné la chimie pour devenir ingénieur des ponts et chaussées et, enfin, consul. On ne sait pas sûrement si cette reconstitution a eu lieu sur place ou au Caire. Il semblerait que ce soit plutôt au Caire car il était prévu d'organiser un nouveau voyage au lac Natron en février 1801, auquel Regnault et le minéralogiste Rozière devaient participer, et ce voyage n'a pas pu avoir lieu. Une question est posée à propos de l'aide que les premiers travaux de Coulomb auraient pu apporter à la compréhension du rôle de l'électricité dans les réactions chimiques. M. Fétizon et M. Grison observent que ces travaux portaient sur l'électricité statique. C'est la construction d'une pile de Volta à l'Ecole polytechnique, fournissant de l'électricité " galvanique " avec une puissance suffisante, qui a permis de produire par électrolyse du sodium et du potassium. Il n'était pas possible de mettre en évidence ce lien entre la chimie et l'électricité quand on ne connaissait que l'électrostatique. M. Jacques apporte quelques informations sur les circonstances dans lesquelles il a découvert le manuscrit de Berthollet. Dans les années 50, sur le boulevard Haussmann, un libraire vendait à la fois des livres et des autographes. Dans un de ses catalogues figurait un dossier concernant des papiers de Dulong. En consultant ces manuscrits M. Jacques a constaté qu'ils étaient très hétérogènes. Certains concernaient effectivement Dulong, par exemple l'autorisation de faire son masque mortuaire, des notes de cours qu'il avait prises ..., mais il y avait aussi un paquet de 150 pages environ, couvertes d'une écriture très différente. Ce texte était intitulé, assez curieusement, essai de revue de la statique chimique. Il a reconnu l'écriture de Berthollet, régulière, très caractéristique, et il a acheté le tout pour un prix peu élevé. Par la suite cette revue de la statique chimique a été l'objet de la thèse de Madame Goupil et le point de départ de ses travaux sur l'affinité, un document qu'il est intéressant de relire. Entre autres choses il y avait aussi des notes très dispersées comme celles qui traitaient de l'action de la lumière, ou des idées de Berzellius. Ceci n'a pas été exploité, il serait bon de l'étudier attentivement. Quant au billet par lequel Berthollet demande à une amie de la famille, Mme Vimeux, d'apprendre à son épouse qu'elle n'a plus de fils, M. Jacques l'a trouvé chez un marchand d'autographes. |