



Au cours des années 1805-1825, l'Ecole polytechnique est un foyer très actif de recherches physico-chimiques. La chimie est l'objet de cours magistraux et de travaux pratiques. Des professeurs avec leurs assistants y font fonctionner des laboratoires d'enseignement et de recherches. Ampère qui, à partir de 1804, est logé à l'Ecole polytechnique se trouve entouré des plus éminents chimistes français : Gay-Lussac, Thénard, Biot et Dulong plus tard, tous patronnés par Berthollet. Ampère qui est d'abord mathématicien et physicien, constate : « A l'égard de la chimie, je ne saurais y faire de découvertes puisque je ne peux faire d'expérience. Je me borne à réfléchir sur celles qu'on a faites depuis peu et dont la plupart ne sont pas encore publiées, ce qui fait que je n'en ai que des notions très vagues. Néanmoins, j'aperçois beaucoup de conséquences qui vont lui faire faire des pas immenses, ou même la changer de face ». (1)

Dès la découverte de la pile Volta en 1800, les chimistes se passionnent pour les phénomènes qui se produisent lorsqu'on soumet les substances à l'électrolyse. C'est ainsi que l'on découvre de nouveaux corps : le potassium, et le sodium en 1807 ; l'iode en 1811 ; et entre temps, le chlore par décomposition de l'acide muriatique. Nous trouvons Ampère mêlé à toutes les discussions sur la nature de ces corps.
De plus Ampère réussit à publier trois sortes de travaux en chimie, qui ne demandent aucune expérimentation de sa part :
2) une démonstration de la loi de Mariotte (2) ; l'étude des gaz est bien du domaine de la chimie car ceux-ci sont considérés, à l'époque, comme une combinaison de "calorique" et d'un radical spécifique pour chacun d'eux.
3) une théorie géométrique de la combinaison chimique basée sur une synthèse des résultats de la cristallographie d'Haüy, des lois sur les proportions définies et multiples et de la loi volumétrique sur les gaz de Gay-Lussac.

Le chlore
Lorsque Scheele [1742-1784] mettait en contact l'acide muriatique [HCl] sur la pyrolusite [Mn02] finement pulvérisée, il constatait que l'acide acquérait une odeur suffocante, semblable à celle de l'eau régale chaude. Il supposait que la pyrolusite s'emparait du "phlogistique" contenu dans l'acide muriatique et que le produit obtenu [le chlore] pouvait être désigné par "acide muriatique déphlogistiqué". Actuellement on écrirait la réaction d'oxydo-réduction ainsi :
En 1785, Berthollet [1748-1822] pensait que le gaz suffocant obtenu ainsi était un composé d'acide muriatique et d'oxygène qu'il nommait : acide oxymuriatique. De fait, les solutions de chlore laissées à la lumière se décomposaient en donnant de l'oxygène gazeux, ce qui dans le cadre conceptuel de l'époque, pouvait très bien s'interpréter comme une décomposition de « l'acide muriatique déphlogistiqué » en acide muriatique et oxygène.

En Juillet 1810, dans une communication lue à la Royal Society, le grand chimiste anglais Humphry Davy [1778-1829] entreprend le commentaire détaillé du mémoire de Gay-Lussac et Thénard de 1809 au sujet de l'acide oxymuriatique et fait remarquer : « Un des phénomènes les plus singuliers que j'ai observé à ce propos... est que le charbon, même chauffé à blanc dans du gaz d'acide oxymuriatique... n'y produit aucun effet... Cette expérience, que j'ai répétée à plusieurs reprises, m'a conduit à douter que cette substance contînt l'oxygène » (3).
Il est en mesure de conclure peu de temps après que cet « acide », étant insensible au charbon, ne contient pas d'oxygène et qu'on doit le nommer d'un autre nom : « ... basé sur une de ses propriétés les plus évidentes et caractéristiques : sa couleur, et de l'appeler "chlorine" ou gaz chlorique du mot grec 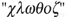 qui signifie "vert" » (4).
qui signifie "vert" » (4).
Ampère, de son côté, s'intéresse fort à la question du caractère élémentaire du chlore. Il écrit une première lettre à Davy, datée du 1er novembre 1810 : « ... il m'a semblé évident que, pour refuser au gaz oxy-muriatique le nom de corps simple, il faudrait renoncer à cet axiome de la chimie moderne qu'on doit donner ce nom à tous les corps qu'on n'a point encore décomposés. J'ai été également frappé de l'analogie des gaz oxygène et oxy-muriatique, celui-ci formant, avec des corps combustibles comme l'hydrogène, le soufre, le phosphore, l'étain, etc., des acides qu'on pourrait nommer : acide hydromuriatique [HCl] ; acide sulfuro-muriatique [SCl2] ; acide phosphoro-muriatique [PCl3] ; acide stanno-muriatique [SnCl2], etc. ... » (5) . En outre, dans cette lettre, Ampère interprète correctement la réaction de la solution de chlore laissée à la lumière ainsi que la réaction de formation du chlore (acide oxy-muriatique) à partir du dioxyde de manganèse : « Tout cela suppose que l'oxygène que l'on obtient en exposant l'acide oxy-muriatique liquide à la lumière vient de l'eau décomposée et que l'oxyde noir de manganèse donne naissance au gaz oxy-muriatique, parce que son oxygène enlève, pour former de l'eau, l'hydrogène uni à ce gaz dans l'acide hydro-muriatique ». Autrement dit dans notre formalisme actuel :
On peut remarquer que ces deux dernières réactions ne figurent pas explicitement dans le mémoire que Davy a lu à la Royal Society en juillet 1810, mais elles sont clairement explicitées dans le second mémoire de Davy du 15 novembre 1810, après qu'il ait reçu la lettre d'Ampère.
Il est manifeste que dans la compréhension de la chimie du chlore, Ampère et Davy sont en phase et en avance sur les autres chimistes français : Berthollet, Gay-Lussac et Thénard.

L'iode
Jusqu'ici, pour obtenir du salpêtre en brûlant des algues brunes (Fucus, Laminaria...,) on recueillait des cendres riches en chlorures, bromures, iodures, carbonates et sulfates de sodium, potassium, magnésium et calcium mais on ne cherchait à garder que les composés de sodium et de potassium. Les liqueurs mères que l'on obtenait par extraction à l'eau étaient connues sous le nom de salin de varech ou soude de varech. Pendant le processus d'évaporation, le chlorure de sodium commençait à précipiter et, un peu plus tard, le chlorure et le sulfate de potassium. Pour détruire les composés sulfurés : polysulfures, sulfites et hyposulfites résultant de la réduction des sulfates lors de la calcination, il fallait ajouter de l'acide sulfurique dans la liqueur mère.
Un jour de 1811, ayant sans doute utilisé un excès d'acide, un salpêtrier Bernard Courtois [1777-1828] a la surprise de constater un dégagement de vapeurs violettes, qui ont une odeur irritante semblable à celle du chlore. Lorsque ces vapeurs se condensent sur des objets froids, elles ne donnent aucun liquide mais de jolis cristaux très foncés d'un bel aspect métallique.
Bien que ces propriétés saisissantes lui fassent suspecter la présence d'un nouvel élément, Courtois ne dispose ni d'un laboratoire suffisamment équipé, ni du temps nécessaire à de telles recherches, les guerres de l'Empire exigeant de grosses livraisons de salpêtre. Aussi demande-t-il à deux de ses amis comme lui originaires de Dijon, C.-B. Désormes et N. Clément, de poursuivre cette investigation, dans leur laboratoire du Conservatoire des Arts et Métiers.
L'annonce par Clément et Désormes de la découverte de l'iode n'a lieu que deux ans plus tard, le 29 novembre 1813 à l'Institut. Ils donnent tous les détails pour l'obtention de la nouvelle substance selon le procédé découvert par Courtois et suggèrent que, combinée à l'hydrogène, elle semble donner de "l'acide muriatique". C'est alors que Gay-Lussac qui a été nommé rapporteur des travaux présentés par Clément, se met à l'étude de cette nouvelle substance. Dès lors Gay-Lussac et Davy entrent en compétition et les conclusions qu'ils donnent, le 12 décembre pour le premier et le 13 pour le second, sont pratiquement les mêmes, aussi les historiens des sciences admettent qu'ils doivent se partager tous deux l'honneur d'avoir élucidé la nature de l'iode. Mais quelle part Ampère a-t-il joué dans la découverte du caractère élémentaire de l'iode ?
En juin 1813, Ampère qui connaît la découverte de Courtois et les travaux de Clément et Désormes, écrit à Davy : « Aujourd'hui toutes les substances simples semblent se partager en deux grandes classes : les corps comburants et les corps combustibles. L'existence de deux comburants, l'oxygène et le chlorine, est actuellement mise hors de doute. Le fluorine va s'y joindre, et peut-être en trouvera-ton bientôt un quatrième dans une substance nouvelle, récemment découverte en France, et dont j'ai vu des effets extrêmement singuliers, mais sur laquelle je ne puis encore vous donner aucun détail » (6).

Lorsque Davy arrive en France le 20 octobre 1813, quelle n'est pas sa surprise de constater que Mr Ampère : « qu'il considérait comme le seul chimiste de Paris à avoir pleinement compris la valeur de ses découvertes » vienne le trouver en compagnie de Clément et Désormes pour lui donner un échantillon de la substance découverte par Courtois, deux ans auparavant. Sir Humphry Davy s'empresse de faire plusieurs expériences, avec son matériel portatif de voyage, ce qui lui permet d'être compétitif vis-à-vis de ses homologues français.
Plus tard, en 1815 A.-M. Ampère, avec une pointe de regret, confie à son ami le philosophe Ballanche : « Heureux ceux qui cultivent une science à l'époque où elle n'est pas achevée, mais où sa dernière révolution est mûre ! La voilà faite entièrement par Gay-Lussac qui achève l'ébauche créée par le génie de M. Davy, mais que j'eusse infailliblement faite, que j'ai faite réellement le premier, mais que, malheureusement, je n'ai pas publiée quand il en était temps. Que m'importe au reste » (7).
Le fluor
Comme on le sait, il faudra attendre jusqu'en 1886 pour que Henry Moissan réussisse à isoler le fluor gazeux sur l'anode de platine iridiée d'une cuve à electrolyse contenant une solution de fluorure acide de potassium dans l'acide fluorhydrique anhydre.
Mais les terres contenant du fluor à l'état de fluorures étaient connues depuis très longtemps et désignées par le nom de spath fluor.

En 1771, Scheele avait fait l'investigation du spath fluor ; ce minerai chauffé dans de l'huile de vitriol [H2SO4] corrodait le verre. Il avait conclu, entre autres, que le spath fluor consistait essentiellement en une terre calcaire saturée d'un acide spécifique. Il s'était aperçu, de plus, que l'acide du spath fluor pouvait dissoudre la terre siliceuse ce qui rendait pratiquement impossible sa préparation dans des récipients en verre.
La décennie suivante, les chimistes J. C. F. Meyer (1781), C. F. Wenzel (1783) et Scheele (1786) prirent l'habitude de préparer l'acide dans des vases métalliques, en étain ou en plomb, et commencèrent à obtenir de petites quantités d'acide fluorhydrique pratiquement pur en solution (8).
Mais au cours de l'année 1809, en chauffant un mélange de spath fluor, supposé exempt de silice, dans l'acide sulfurique bouillant Gay-Lussac et Thénard sont capables d'interpréter correctement l'obtention de l'acide fluorique pur selon la réaction : CaF2 + H2SO4 -> 2HF + CaSO4 (formalisme actuel).
De plus, ils élucident l'action de l'acide fluorhydrique sur la silice et sur l'oxyde borique.
Les historiens des sciences retiennent généralement que c'est Ampère qui suggère à Davy que l'acide fluorhydrique doit être un composé d'hydrogène et d'un élément inconnu analogue au chlore et à l'iode et qu'il propose de nommer fluor, puis phtore. En effet, la correspondance entre Ampère et Davy ne laisse aucun doute à ce sujet. Le 1er novembre 1810, Ampère fait part de ses réflexions au célèbre chimiste :
« .. .Permettez-moi de donner à ce troisième corps comburant le nom d'oxy-fluorique [fluor] ; il se trouverait combiné avec le calcium dans ce qu'on appelle le fluate de chaux. Quand cette dernière substance est chauffée dans un tube de plomb avec de l'acide sulfurique concentré où il y a toujours de l'eau, l'oxygène de cette eau convertirait le calcium en chaux pour donner naissance au sulfate de chaux qui se forme, et son hydrogène se combinerait avec l'oxy-fluorique pour former cet acide hypofluorique [HF] sous forme liquide, qui produit de si terribles effets sur les corps vivants. Celui-ci mis en contact avec l'oxyde de silicium, il y aurait formation d'eau et le silicium uni à l'oxy-fluorique donnerait ce gaz qu'on nomme acide fluorique silice, que, dans cette hypothèse on devrait appeler acide silicio-fluorique [SiF4] et qui serait analogue aux autres acides gazeux ».
Cette lettre indique clairement qu'Ampère fait l'hypothèse de l'existence d'un troisième corps comburant analogue au chlorine et à l'oxygène. Il n'ose pas encore l'appeler fluorine (par analogie au chlorine) et l'appelle oxy-fluorique (par analogie à l'oxy-muriatique, ancien nom donné au chlore) alors qu'il est déjà à peu près persuadé, comme Davy, que le chlore ne contient pas d'oxygène.
Il postule la formation de SiF4 (acide fluorique silice) et de BF3 (acide boro-fluorique) ; et, en continuant les analogies entre le fluor et le chlore, il soupçonne qu'il est possible de former des combinaisons binaires entre le fluor et le soufre et entre le fluor et le phosphore.
Ampère ne se trompe guère en suggérant d'isoler la substance inconnue combinée avec l'hydrogène dans l'acide hydrofluorique par electrolyse de l'acide anhydre en utilisant une anode en carbone puisque ce procédé sera utilisé plus tard (et encore de nos jours) pour préparer industriellement le fluor (9).
La réponse de Davy écrite le 8 février 1811 ne parviendra à Ampère que le 14 août 1812 (dix-huit mois plus tard !) : « ... Vous avez mis en évidence d'une manière magistrale les analogies entre les gaz fluorique [HF] et muriatique [HCl] Je ne vois qu'une objection à vos vues, c'est qu'il semble se former de la potasse en brûlant du potassium dans le gaz silico-fluorique [SiF4] ; ce qui semble impliquer qu'il y a en lui quelque substance contenant de l'oxygène... » (10).
L'objection que fait Davy est assez faible. Il pense que si de la potasse [oxyde de potassium] se forme en faisant brûler du potassium dans du SiF4, ce dernier ainsi que l'acide fluorique [HF] de départ contiendraient de l'oxygène ?
Ampère n'a pas de difficulté à lever l'objection de Davy, dans la lettre très détaillée qu'il lui adresse le 26 août 1812 . Il explicite sans ambiguïté les réactions suivantes :
Donc, de la potasse se forme seulement si on laisse de l'eau dans le mélange réactionnel.
Les arguments d'Ampère sont totalement acceptés par Davy si l'on en juge par la lettre qu'il lui adresse le 6 mars 1813 : « Vos vues ingénieuses concernant le fluor peuvent être confirmées. J'ai quelques raisons pour conclure de mes expériences qu'il n'y a pas d'oxygène combiné avec le potassium dans l'expérience sur la combustion du potassium dans le gaz silico-fluoré et que la première vue que je me formais à ce sujet était incorrecte ».
Le 8 juillet 1813, H. Davy reconnaît l'analogie frappante entre le chlore et le fluor et remercie Ampère pour sa contribution originale.
Cette fois-ci Ampère prend soin de faire connaître à la communauté scientifique le rôle qu'il a joué pour établir la nature élémentaire du fluor et la composition de l'acide fluorhydrique.
L'impression générale qui se dégage de l'attitude d'Ampère au cours du débat scientifique sur la découverte du caractère élémentaire des trois halogènes : chlore, iode, fluor est, nous semble-t-il, son ouverture d'esprit, sa façon très vive de saisir les analogies, et de croire à l'unité de lois naturelles. Ce qui semble clair c'est qu'Ampère est enclin à suivre Davy et à interpréter de la même façon que lui les nouveaux faits chimiques et qu'il a sûrement du mal, n'étant pas chimiste lui-même, à se faire entendre par ses collègues, qui doivent se demander de quoi il se mêle. Ampère et Davy sont tout deux des autodidactes, aussi peuvent-ils s'autoriser une indépendance de pensée, que ni Gay-Lussac et ni Thénard, protégés de Berthollet, ne peuvent se permettre.
La liste des corps simples ne cessant de s'accroître, en 1816, Ampère imagine une méthode de classification pour ceux-ci. Il a l'idée d'appliquer "la méthode naturelle" (12) mise au point par J.-A. Jussieu en botanique à la chimie. Ampère s'intéresse aux classifications des êtres de la nature. Il croit, en l'existence d'un ordre naturel, que seule une "méthode naturelle" pourra atteindre : « il me paraît qu'on doit s'efforcer de bannir de la chimie les classifications artificielles et commencer par assigner à chaque corps simple la place qu'il doit occuper dans l'ordre naturel... ». Pour Ampère, chaque corps simple est un être suffisamment bien défini pour qu'il soit considéré comme une "espèce" au sens des naturalistes. Aussi va-t-il se préoccuper de délimiter des "genres" naturels à partir de l'étude de toutes les caractéristiques que chacun d'eux présente. Mais si l'objet en botanique dépend exclusivement de l'observation, l'objet chimique dépend beaucoup de l'expérimentation qui seule peut révéler les analogies chimiques. Ampère, nous l'avons dit, est très au courant des résultats des chimistes expérimentateurs et il va s'en servir pour théoriser sa classification des corps simples de la chimie.
Il se conforme à l'idée de "série", où chaque élément chimique de la série diffère du précédent par une variation assez faible de l'ensemble de tous ses caractères. Ainsi, la série que découvre Ampère, en la construisant est une boucle fermée où : « chaque genre se trouvant placé, dans l'ordre naturel, entre deux autres qui ne peuvent en être séparés, on est libre de choisir à volonté celui qu'on étudiera le premier pourvu que, des deux genres qui s'en rapprochent le plus, l'un soit examiné immédiatement après et l'autre le dernier de tous ». Cette idée de continuité est à l'origine de la notion d'analogies horizontales dans le futur tableau périodique (11).
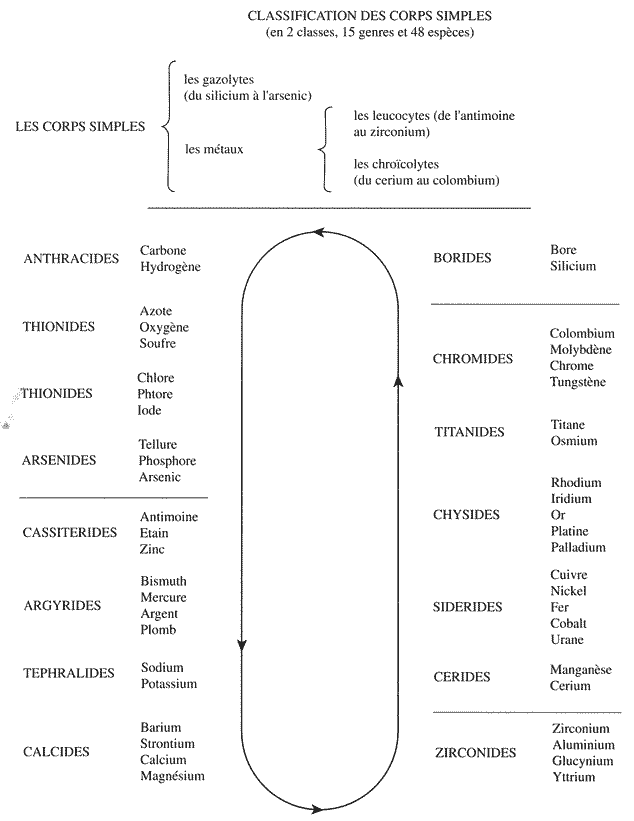
Pour classer les corps simples, Ampère ne veut pas sélectionner un ou deux caractères jugés a priori prépondérants, ce qui aboutirait à une classification artificielle. Au contraire, il s'agit de considérer pour chaque corps simple l'ensemble des caractères ayant une signification chimique et qui pour être découverte exige une démarche expérimentale construite.
Ampère commence par former des portions de chaîne qu'il appelle "genres"; il en constitue quinze à partir des quarante huit corps simples, ou espèces, connus à l'époque. Il distribue ces genres en deux grandes classes les "gazolytes" et les "métaux" et subdivise la classe des métaux en deux groupes "les métaux leucolytes" et "les métaux chroïcolytes". Il suit une marche ascendante, c'est à dire des individus aux genres puis aux classes, et une marche descendante inverse, comme l'avait fait De Jussieu en botanique. Chaque genre possède de deux à cinq corps simples qui se ressemblent par un ensemble de caractères qu'il juge déterminants ; pour ce faire, Ampère inventorie toutes les réactions entre corps simples, connues à son époque. La classe des gazolytes comprend tous les corps qui « sont susceptibles de former, avec d'autres substances de la même classe des gaz permanents qui puissent subsister sans se décomposer lorsqu'ils sont mêlés à l'air atmosphérique ». On peut remarquer ici que le fait pour un corps simple de former un corps gazeux avec un autre corps simple de la même classe n'est pas une propriété chimique. Il s'agit d'une caractéristique physique : l'état gazeux qui n'est pas une donnée pertinente en chimie, cependant les "gazolytes" ainsi répertoriés qui sont "les non métaux" sont des corps qui se ressemblent pour un tas d'autres raisons, chimiques évidemment, et Ampère naturellement en tient le plus grand compte. Dès lors, la deuxième classe comportera tous les corps simples qui ne présentent pas cette propriété, c'est à dire, les métaux. Ampère se rend compte, par l'examen de la réactivité des métaux que l'on peut les séparer en deux séries : les "leucolytes" (du grec blanc, clair, transparent) qui forment dans les acides des dissolutions incolores, et les "chroïcolytes" ( du grec coloré) qui forment dans ces mêmes acides des dissolutions colorées. Cette particularité semble d'ailleurs reliée à une autre, sans que l'on sache pourquoi : la fusibilité ; en effet, les "leucolytes" sont facilement fusibles, alors que les "chroïcolytes" exigent une très haute température pour fondre. Ici, nous le constatons, Ampère associe des analogies de caractère physique, c'est à dire accessibles par l'observation seule - la coloration des dissolutions acides des métaux et leur fusibilité - à des analogies de caractère chimique qui exigent pour être reconnues une étude complète de la réactivité des corps simples entre eux. Il subodore implicitement, nous semble t-il, que des caractéristiques physiques observables à l'échelle macroscopique peuvent avoir des raisons chimiques actuellement inconnues, à l'échelle microscopique.
En effet, les métaux pour Ampère, ne doivent pas être classés en observant leurs seules qualités physiques. Le souci constant d'Ampère est d'établir des rapports entre caractères, quels qu'ils soient, pour saisir les analogies chimiques.
Dans un deuxième temps, il lui faut chercher les limites qui séparent chaque genre de tous les autres ; les corps simples d'un même genre ne doivent pas se succéder au hasard, afin de respecter une continuité à l'intérieur du même genre et aussi entre les genres entre eux (12). Ampère s'applique à chercher, celui des corps simples qui établit dans chaque genre, la transition avec le genre suivant ou le genre précédent dans la série, par exemple : « l'analogie extrêmement marquée qu'on observe entre le cérium et les métaux du genre précédent, détermine l'ordre suivant lequel ils doivent être placés ».
La classification des corps simples d'Ampère, relativement ignorée par les épistémologues et historiens des sciences, révèle à l'examen des aspects novateurs pour l'époque (13). Tout d'abord, en se servant "d'une méthode naturelle" il donne du poids à l'idée qu'il existe un ordre naturel pour le classement des corps simples (14). Ampère montre qu'un corps simple particulier se classe dans une famille par la considération d'une somme de propriétés synthétiques plutôt que par la connaissance d'un caractère bien déterminé et saillant. Il réalise un progrès important dans la constitution des "familles naturelles" qu'il appelle "genres" et qui plus est, ces familles ne sont pas des collections d'objets indépendants entre eux, il existe un ordre dans la succession des familles et cet ordre n'est pas très éloigné de celui du futur tableau périodique" (15). De plus la classification d'Ampère n'est pas rigide, sa souplesse et son adaptabilité sont un moyen de faire progresser la connaissance (16).
Ampère va élaborer une théorie de la combinaison chimique (17), où il énonce une hypothèse longtemps refusée par la communauté scientifique et que nous appelons aujourd'hui "la loi d'Avogadro-Ampère".
En mars 1813, il fait part de ses espoirs à son ami Roux : « Mes conversations avec M. Davy m'avaient donné une impulsion des plus grandes pour la chimie. Je me suis occupé environ deux mois d'un travail dont le résultat me semblait devoir ouvrir dans cette science une nouvelle carrière et donner le moyen de prévoir a priori les rapports fixes suivant lesquels les corps se combinent, en rapportant leurs diverses combinaisons à des principes qui seraient l'expression d'une loi de la nature, dont la découverte sera peut-être, après ce que j'ai fait l'été passé en métaphysique, ce que j'aurai conçu de plus important dans toute ma vie [...] car la théorie des combinaisons chimiques [...] deviendra une chose aussi usuelle dans les sciences physiques que les autres théories généralement admises ».
Ampère, tout comme Laplace et Berthollet, a une vision statique de la structure intime de la matière : « la manière dont sont arrangées les molécules des corps est telle qu'il n'y a pas plus de mouvement dans les liquides et les gaz que dans les solides». Les distances entre particules dépendent de trois sortes de forces : « la pression qu'ils supportent, la répulsion entre leurs particules, produite par le calorique, et les forces attractives et répulsives propres à chacune des particules qui dépendent de leur nature et impriment des qualités diverses aux corps d'espèces différentes ».
Ces forces jouent des rôles différents dans les trois états de la matière ; à l'état solide deux forces prédominent, les forces attractives et répulsives propres aux particules et la force répulsive du calorique ; à l'état liquide les deux forces précédentes jouent mais aussi celle de la pression atmosphérique ; à l'état gazeux, seules, deux forces agissent encore : la pression de l'atmosphère et la répulsion produite par le calorique.
Ampère va bâtir sa théorie de la combinaison chimique en se basant sur deux arguments expérimentaux indéniables ; d'une part, les formes primitives établies par Haüy, en cristallographie, à partir du clivage des cristaux, et la loi volumétrique de Gay-Lussac (1809) sur les combinaisons en phase gazeuse, d'autre part.
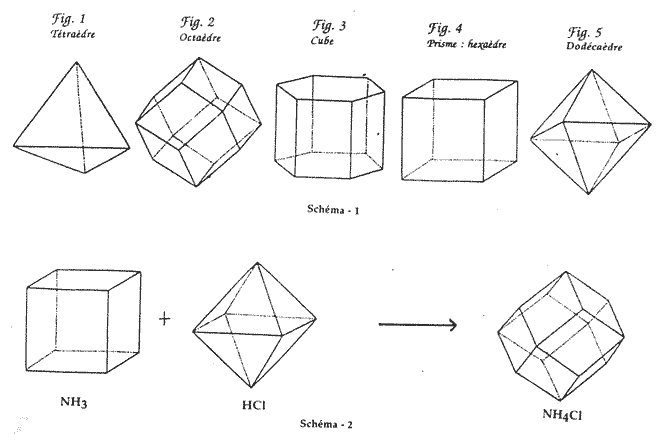
Selon Haüy, les cristaux macroscopiques proviennent d'un assemblage de groupes moléculaires de formes régulières. Les opérations de clivage révèlent que les formes secondaires d'une même substance cristallisable, qui sont souvent différentes, se déduisent d'un même polyèdre régulier : "la forme primitive". Il n'existe qu'un petit nombre de formes primitives : le parallélépipède, le tétraèdre régulier, l'octaèdre à faces triangulaires, le prisme hexagonal, le dodécaèdre à faces rhombes, et le dodécaèdre à plans triangulaires (18).
Des six formes primitives de la cristallographie d'Haüy, Ampère en conserve cinq : le tétraèdre, l'octaèdre, le parallélépipède, le prisme hexaèdre, le dodécaèdre rhomboïdal, qu'il nomme "forme représentative" des particules de matière. Ces polyèdres ne doivent leur stabilité qu'aux forces d'attraction et de répulsion qui s'exercent entre les "molécules-points" disposées à leurs sommets. Ainsi, en supposant que les "formes représentatives" ou "particules" de matière sont conservées à l'état gazeux, écartées certes davantage par la force répulsive du calorique, mais conservant leur identité propre, Ampère donne un premier fondement à sa théorie.
Le deuxième fondement de la théorie d'Ampère est la "loi volumétrique", que Gay-Lussac exprime ainsi : « J'ai fait voir que les combinaisons des substances gazeuses les unes avec les autres se font toujours dans des rapports les plus simples, et tels qu'en représentant l'un des termes par l'unité, l'autre est un ou deux, ou au plus trois. Les contractions apparentes de volume qu'éprouvent les gaz en se combinant ont aussi des rapports simples avec le volume de l'un d'entre eux » (19). Ampère interprète cette loi en faisant l'hypothèse que des volumes égaux de tous les gaz pris dans les mêmes conditions, contiennent le même nombre de particules. Cette hypothèse qui a été formulée par Avogadro en 1811 (20), semble à l'époque beaucoup plus risquée que celle de l'existence des "formes représentatives", et elle ne fera pas de consensus chez les contemporains d'Ampère. Or, cette hypothèse donne une fécondité incontestable à la loi expérimentale de Gay-Lussac. En effet, nous dit Ampère : « En la supposant admise, il suffira de connaître les volumes à l'état de gaz d'un corps composé et de ses composants, pour savoir combien une particule du corps composé contient de particules ou de portions de particule des deux composants ».
Ampère attribue aux gaz simples "permanents", connus à l'époque, l'oxygène, l'hydrogène et l'azote la "forme représentative" polyédrique la plus simple : le tétraèdre ; pour le chlore, dont on ignore encore la nature simple, il choisit le cube. Ce qui donne, par exemple :
Oxygène + azote = gaz nitreux1/2 volume + 1/2 volume = 1 volume (loi de Gay-Lussac)
1/2 particule + 1/2 particule = 1 particule (hypothèse d'Ampère)
1/2 tétraèdre + 1/2 tétraèdre = 1 tétraèdre
2 molécules + 2 molécules = 4 molécules
O2 + N2 = 2 NO (écriture actuelle)
Ou encore :
Hydrogène + chlore = acide muriatique1/2 volume + 1/2 volume = 1 volume (loi de Gay-Lussac)
1/2 particule + 1/2 particule = 1 particule (hypothèse d'Ampère)
1/2 tétraèdre + 1/2 cube = 1 octaèdre
2 molecules + 4 molecules = 6 molecules
H2 + Cl2 = 2 HCl (écriture actuelle)
Pour Ampère l'explication causale de la combinaison chimique est possible. Elle se trouve dans la possibilité de superposition de polyèdres : « Quand des particules se réunissent en une particule unique, c'est en se plaçant de manière que les centres de gravité des particules composantes, étant au même point, les sommets de l'une se placent dans les intervalles que laissent les sommets de l'autre, et réciproquement. S'il n'en est pas ainsi, la combinaison ne peut se former et les particules seront simplement "juxtaposées " ou "agrégées" ».
Ainsi, 1 tétraèdre + 2 octaèdres ne peuvent se combiner, il en résulte une figure bizarre. Par contre, 1 octaèdre et 2 tétraèdres peuvent parfaitement se combiner, la figure résultante étant le dodécaèdre, figure parfaitement symétrique. Et donc, si A a pour forme représentative le tétraèdre et B l'octaèdre : AB2 (écriture actuelle) n'est pas possible, alors que A2B l'est.
Le cas de la formation du chlorure d'ammonium est pour Ampère un cas particulièrement intéressant puisque les deux composants, l'acide muriatique et l'ammoniac réagissent tous les deux à l'état gazeux pour former un composé solide à température ambiante. Il devient possible de valider la théorie par l'expérience :
Gaz muriatique + gaz ammoniacal = sel d'ammoniac1 volume + 1 volume = composé solide
1 particule + 1 particule = 1 particule
1 octaèdre + 1 cube = 1 dodécaèdre rhomboïdal
HCl(g) + NH3(g) = NH4Cl(s)
Ampère s'attend, si sa théorie est exacte, à trouver pour NH4Cl un dodécaèdre rhomboïdal, et dit-il : « .. .cette forme est en effet une de celle qui appartiennent au système de cristallisation du sel ammoniac, et tous les autres pourraient, par conséquent, y être ramenés par différents décroissements ». Pour Ampère le problème de la combinaison chimique est résolu, si l'on admet qu'il s'agit d'une simple composition de polyèdres. Si la composition de polyèdres aboutit à un polyèdre symétrique et régulier, la combinaison chimique a lieu, sinon les composants restent "juxtaposés" ou "mêlés" et on n'observe pas de proportions constantes ni dans les poids ni dans les volumes gazeux.
La théorie chimique d'Ampère, tentative de chimie structurale avant l'heure, a le mérite d'introduire des règles de combinaison chimique qui présupposent l'existence d'édifices stables (nous dirions de molécules), à une époque où l'actuelle distinction atomes/molécules n'est pas encore faite. La nouveauté conceptuelle d'Ampère, pour l'époque, nous apparaît ainsi avec plus de force. Il fait nettement la distinction entre "forces physiques" qui ne détruisent pas les particules et "forces chimiques" qui les détruisent (21).
Notons qu'à cette époque, Berthollet, dans la poursuite du rêve newtonien, cherche dans l'équilibre de toutes les forces en présence à traiter l'affinité chimique comme un problème de mécanique. John Dalton de son côté, ayant défini les "atomes chimiques" différents d'un corps simple à l'autre et tous identiques pour une même substance, envisage la réaction chimique comme une simple juxtaposition d'atomes, sans aborder le pourquoi de la réactivité chimique. Quant à Berzelius, s'appuyant sur les résultats de H. Davy sur l'électrolyse, il attribue aux atomes daltoniens des charges électriques soit positives soit négatives et explique la réactivité par une attraction électrostatique entre atomes.

Ampère, quant à lui, s'efforce de donner une interprétation géométrique donc mathématique de la combinaison chimique et il révèle par là son talent de théoricien qu'il se plait à appliquer à la chimie, science qui le passionne.
(1) Correspondance du Grand Ampère, (L. de Launay Ed.) Gautier Villars, Paris, 1936, lettre du 29.11.1809 à Bredin, tome 3, p. 871.
(2) A.-M. Ampère, « Démonstration de la relation découverte par Mariotte ... », Annales de chimie et de physique, 94, 1814, 145-160.
(3) H. Davy, Collected Works, éd. John Davy, Londres, 1839-1840, tome 5, p. 285.
(4) ibid., p.345.
(5) Correspondance du Grand Ampère, loc. cit., lettre à Humphry Davy du 1er novembre 1810, Louis de Launay accompagne cette lettre du commentaire : « C'est en 1807 que Davy réussit à obtenir le potassium par la pile de Volta. Ses expériences, communiquées à l'Institut le 29 février 1808, furent aussitôt répétées à Paris. Mais on discutait pour savoir s'il s'agissait de véritables métaux ou d'hydrures. Ampère, dans une note autographe, écrit : "La petite quantité de potassium et de sodium produite par ce moyen (de Davy) ne permettait pas de les soumettre à toutes les expériences propres à décider la question. Peut-être même serait-elle toujours restée indécise si nous n'avions trouvé le moyen de se procurer les substances métalliques découvertes par M. Davy, en telle quantité que l'on veut par un moyen purement chimique". Mais, comme beaucoup d'autres travaux d'Ampère, celui-là est resté inédit et, officiellement, c'est Gay-Lussac et Thénard qui obtinrent le potassium en grande quantité par l'action du fer sur la potasse (recherches physico-chimiques, I, 1811, p. 74-386).».
(6) Correspondance, loc. cit., lettre à Davy du 20 juin 1813, tome 2, p. 444-446 ; p.444.
(7) ibid, p. 482.
(8) J. R. Partington "The early history of hydrofluoric acid" Mem. Proc. Manchester, lit. philos, soc., 67,1923, p. 73-87.
(9) Heslop and Robinson, "Chimie inorganique', Paris, Flammarion, sciences, 1973, p. 553.
(10) Correspondance du Grand Ampère, loc.cit, tome 1, p. 363.
(11) C'est cette même idée qui conduira Beguyer de Chancourtois, en 1862, reconnu comme un des précurseurs du tableau périodique, à établir sa classification selon le principe de la "vis tellurique": "le principe de continuité... m'a conduit à rouler ma feuille, pour rapprocher les extrêmes qui offraient beaucoup d'analogie" B.de Chancourtois, "Comptes rendus hebdomadaires des séances de l'Académie des Sciences, 7 Avril 1862, p.841
(12) La classification des corps simples d'Ampère est critiquée positivement dans le dictionnaire de F. Cuvier, Dictionnaire des Sciences naturelles..., Direc. F.Cuvier, 1818, notice correspondant au mot "corps ", 532 : "...les corps sont tellement coordonnés l'un à l'autre, qu'ils forment non plus une série, mais un cercle. L'auteur parvient à cet ordre 1°) en disposant les espèces d'un même genre de manière que les caractères de ce genre se trouvent au plus haut degré dans l'espèce qui en occupe le milieu : par ce moyen les propriétés des espèces extrêmes lient ces espèces à la dernière du genre précédent et à la première du genre suivant ; 2°) en disposant les genres d'une même classe, de manière que les propriétés qui caractérisent la classe, se trouvent au plus haut degré dans les genres lacés au milieu de la classe"
(13) Pour une analyse plus détaillée on peut consulter M.Scheidecker-Chevallier et R. Locqueneux "Liens entre philosophie et sciences physiques dans l'oeuvre de A.M. Ampère", Archives Internationales d'histoire des sciences, 129, Vol.42, (1992), 227-268
(14) Plus tard, Dumas, Béguyer de Chancourtois ... et bien sûr Mendéleeff s'appuieront fortement sur une telle "évidence"
(15) La famille des métaux alcalins (les téphralides) est suivie parcelle des métaux alcalino-terreux (les calcides), suivis à son tour par les métaux de transitions. Viennent ensuite la famille du bore (colonne IIIA), celle du carbone (colonne IVA), celle de l'azote (colonne VIA), il ne manque que la famille de l'oxygène (colonne VIA), confondue avec celle de l'azote et la dernière colonne, celle des gaz rares (colonne VIIA), corps simples non encore découverts à l'époque. Le genre des "arsenides" serait à redistribuer entre les familles VA et VIA de même que l'antimoine, l'étain, le bismuth et le plomb tandis que le zinc, l'argent et le mercure devraient figurer dans les genres suivants ( métaux de transition). Le silicium est associé à la famille du bore, au lieu de l'être à celle du carbone qui lui est voisine ; l'aluminium est "assez" mal placé dans le genre des zirconides alors qu'il devrait se trouver dans celui des borides )
(16) Esprit classificateur. Ampère a tenté de classer l'ensemble de toutes les connaissances humaines et dans ce cas, comme pour les corps simples il remarque : " mais cette nécessité même d'étudier à fond les objets dont on s'occupe fait qu'à mesure qu'on découvre de nouveaux rapports, il faut modifier les classifications ; modifications qui tendent de plus en plus vers la perfection..." A.M Ampère, Essai sur la philosophie des sciences, T. 1, Mallet-Bachelier, Paris 1834-1843,2e édition 1856, p. 10.
(17) A.-M. Ampère : Lettre de M. Ampère à M. le Comte de Berthollet, sur la détermination des pmportions dans lesquelles les corps se conéinent d'après le nombre et la disposition relative des nwlécules dont leurs particules intégrantes sont composées, Annales de Chimie, 1814,90,43-86
(18) R.-J. Haüy Exposition abrégée de la théorie sur la structure des cristaux, Paris, Ed.: les directeurs de l'Imprimerie du Cercle Social, 1792,3-52
(19) J.-L Gay-Lussac, « Mémoire sur la combinaison des substances gazeuses, les unes avec les autres », Mémoires de la Société d'Arcueuil, 2,1809,207-234.
(20) A. Avogadro, Essai d'une manière de déterminer les masses relatives des molécules élémentaires des corps et les pmportions selon lesquelles elles entrent dans ces combinaisons, Journal de physique, de chimie et d'histoire naturelle, 1811,73,58-76
(21) M. Scheidecker-Chevallier, L'hypothèse d'Avogadro (1811) et d'Ampère (1814) : La distinction atome/molécule et la théorie de la combinaison chimique, Revue d'histoire des sciences, 1997,50/1-2, 159-194